組成
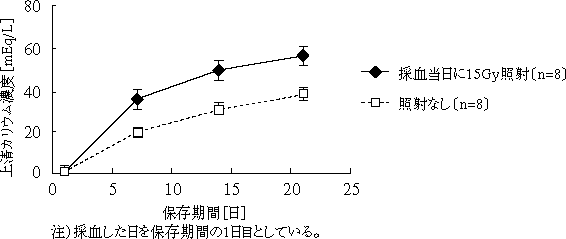
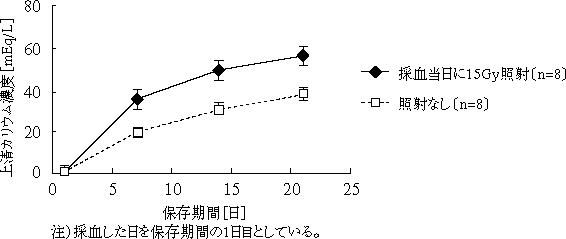
本剤には、輸血による移植片対宿主病 (GVHD: graft versus host disease)4,5) を予防する目的で、15Gy以上50Gy以下の放射線が照射されており、下図に示すように、放射線を照射しない製剤よりも保存に伴い上清中のカリウム濃度が増加することが認められる (採血当日に15Gyの放射線を照射し、採血後21日間保存した400mL由来の本剤1袋に含まれる上清中の総カリウム量はそれぞれ採血当日で平均0.2mEq、7日目で平均4.6mEq、14日目で6.2mEq及び21日目で7.1mEqであり、放射線を照射しない場合は、採血後21日間保存で平均4.9mEqである)。
クエン酸水和物 3.27g
ブドウ糖 23.20g
リン酸二水素ナトリウム 2.51g
―――――――――――――――――――――
注射用水を加えて溶かし、全量を1,000mLとする。
アデニン 0.14g
リン酸二水素ナトリウム 0.94g
クエン酸ナトリウム水和物 1.50g
クエン酸水和物 0.20g
ブドウ糖 7.21g
塩化ナトリウム 4.97g
―――――――――――――――――――――
注射用水を加えて溶かし、全量を1,000mLとする。